B titrasi 20 mL 0100 M iodida dengan 00845 Ag. Pada titrasi baik titrasi asam-basa maupun titrasi lainnya terdapat titik ekuivalen dan titik akhir titrasi.
Gambar 57 Titik ekuivalen.

Titik ekuivalen titrasi. Bagian terjal dari kurva titrasi pada titik ekuivalen dalam selang pH yang sempit dari sekitar 7 sampai 10. Contoh Soal Perhitungan Konsentrasi Asam Sulfat Dengan Titrasi. Jadi keasaman setelah titrasi adalah pH 7.
TE tidak dapat teramati saat dilakukannya eksperimen karena belum terjadi perubahan warna pada larutan indikator maka yang dapat teramati adalah TA titrasi. 2004 Pada saat titik ekuivalen ini maka proses titrasi dihentikan kemudian catat volume titer yang diperlukan untuk mencapai keadaan tersebut. On Kurva Titrasi Asam Basa.
Chemistry The Molecular Nature of Matter and Change Martin. Titik ekivalen dalam titrasi asam basa adalah titik yang menunjukkan saat titran yang ditambahkan bereaksi seluruhnya dengan zat yang dititrasi. Titrasi dilakukan dengan mereaksikan sedikit demi sedikittetes demi tetes larutan basa melalui buret ke dalam larutan asam yang terletak dalam labu erlenmeyer sampai keduanya tepat habis dengan ditandai berubahnya warna indikator disebut titik akhir titrasi.
Pada saat itulah titrasi dihentikan atau dikenal dengan titik akhir titrasi. Indikator fenolftalein berubah warna di sekitar titik ekivalen dan merupakan indikator yang sesuai. SEORANG PENGGUNA TELAH BERTANYA Apa perbedaan titik ekuivalen dan titik akhir titrasi.
Titrasi basa lemah oleh asam kuat akan menghasilkan kurva sebagai berikut. Contoh Cara Menghitung pH pada Titrasi Asam Lemah dengan Basa Kuat. Sebanyak 40 mL larutan H 2 SO 4 belum diketahui konsentrasinya dititrasi dengan larutan NaOH 01 M.
Titrasi Basa Lemah oleh Asam Kuat. Pada titik ini dinamakan titik ekuivalen titrasi. Kurva titrasi a titrasi 40 mL KI 05 M plus 005 M KCl yang dititrasi dengan 00845 M AGNO3.
Terdapat beberapa metode untuk menentukan titik ekuivalen seperti. Kurva Titrasi Asam Basa. Titik ekuivalen dapat dicari dengan menggunakan indikator seperti fenolftalein atau metil jingga.
Titik ekuivalen titrasi tersebut dicapai pada volume NH 4 OH 100 mL sehingga. Pada titrasi terjadi perubahan pH misalkan pada titrasi asam kuat oleh basa kuat maka pH akan meningkat sedikit demi sedikit hingga mendekati titik ekuivalen kemudian meningkat secara signifikan dan kembali meningkat secara perlahan setelah melewati titik ekuivalen. Titik titrasi di mana indikator berubah warna misalnya ketika larutan berubah menjadi merah muda ketika indikator fenolftalein digunakan Saya.
Ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa. Titik ekuivalen TE adalah titik saat asam basa tepat habis bereaksi secara teoritis. Sedangkan titik akhir titrasi adalah titik saat titrasi berhenti dilakukan yaitu saat indikator asam-basa mengalami.
Metode untuk menentukan titik ekuivalen. Dengan memakai data volume titran volume. Jadi keasaman setelah titrasi adalah pH 7.
Apa kegunaan indikator dalam titrasi. Contoh Soal Perhitungan Konsentrasi Asam Sulfat Dengan Titrasi. Kurva titrasi asam basa memplot antara nilai pH dengan jumlah titran yang di tambahkan terhadap analit.
Memakai pH meter untuk memonitor perubahan pH selama titrasi dilakukan kemudian membuat plot antara pH dengan volume titrant untuk memperoleh. Titik ekuivalen diketahui dengan bantuan indikator. 40 mL CH 3 COOH 01 M Ka 17410 5 dititrasi dengan NaOH 02 M.
Jadi dapat disimpulkan bahwa kurva titrasi asam basa itu terdiri atas tiga bagian yaitu bagian yang menandakan pH awal bagian yang menandakan pH saat titik ekuivalen dan bagian yang menandakan pH setelah melampaui titik ekuivalen. Dengan kata lain pada titik ekuivalen jumlah mol titran setara dengan jumlah mol titrat menurut stoikiometri. Sementara itu titik akhir titrasi mengacu kepada titik ketika indikatornya mengubah warna larutan pada saat titrasi.
Ini juga dikenal sebagai titik stoikiometrik karena di situlah mol asam sama dengan jumlah yang dibutuhkan untuk menetralkan mol. Pada titik ini dinamakan titik ekuivalen titrasi. MENENTUKAN TITIK EKUIVALEN PADA TITRASI ASAM BASA.
INI JAWABAN TERBAIK Titik ekivalen titik dimana jumlah titran sama dengan jumlah zat yang akan diidentifikasi. Mol NH 4 OH 100 mL x 01 M 10 mmol. Perbandingan kurva titrasi antara iodida klorida dan bromida.
Titik akhir titrasi ini mendekati titik ekuivalen tapi biasanya titik akhir titrasi melewati titik ekuivalen. Pada titik ekuivalen konsentrasi H yang terdapat dalam larutan sama dengan reaksi ionisasi air. Untuk titrasi yang melibatkan asam lemah atau basa lemah pH pada titik ekuivalen merupakan pH hidrolisis.
Indikator yang dipakai adalah fenolftalein. Kurva titrasi antara iodida dan klorida. 140 120 100 80 60 40 20 00 50 100 150 200.
MENENTUKAN TITIK EKUIVALEN PADA TITRASI ASAM BASA. Sebelum titik ekuivalen misal saat penambahan 10 mL NaOH 02 M. Sebagai contohnya perhatikan kurva titrasi asam kuat dengan basa lemah pada Gambar 2.
Jika 25 mL NH 4 OH 01 M. Mol titran larutan standar sama dengan mol larutan dengan konsentrasi yang tidak diketahui. Titik akhir TA titrasi adalah titik saat indikator asam basa mengalami perubahan warna.
Titrasi asam kuat oleh basa kuat dengan indikator fenolf-talein PP ditandai dengan perubahan warna larutan menjadi merah muda per-tama dan tidak hilang setelah dikocok. Pada titik ekuivalen konsentrasi H yang terdapat dalam larutan sama dengan reaksi ionisasi air. Titik ekuivalen adalah titik teoritis tidak dapat ditentukan berdasarkan eksperimenpercobaan namun ditentukan melalui pengamatn perubahan warna perubahan besar partikel terbentuknya endapan dan perubahan beda potesial John 2003.
Titik akhir titrasi ini mendekati titik ekuivalen tapi seringkali titik akhir titrasi melalui titik ekuivalen. Pemilihan indikator yang cocok untuk titrasi asam lemah oleh basa kuat lebih terbatas yaitu indikator yang mempunyai trayek pH antara 7 sampai 10. Mol HCl 100 mL x 01 M 10.
Dengan membuat grafik ini maka perubahan pH selama titrasi dapat diamati begitu pula dengan titik ekuivalen. Titik ekuivalen adalah titik dalam titrasi di mana jumlah titran yang ditambahkan cukup untuk sepenuhnya menetralkan larutan analit. Volume pada 01000 M NaOH mL.
Gambar insert adalah gambar diperbesar dari titik ekuivalen pertama titrasi. By Indigo Morie November 10 2015. Fungsi penambahan indikator fenolftalein pada titrasi asam basa yaitu untuk menentukan titik ekuivalen.
Oleh sebab itu titik akhir titrasi tidak jarang disebut sebagai titik ekuivalenPada saat titik ekuivalen ini maka proses titrasi dihentikan lalu catat volume titer yang dibutuhkan untuk mencapai suasana tersebut. Oleh karena itu titik akhir titrasi sering disebut juga sebagai titik ekuivalen. Perubahan tersebut digambarkan pada kurva titrasi asam basa.
Sebanyak 40 mL larutan H2SO4 belum diketahui konsentrasinya dititrasi dengan larutan NaOH 01 M dengan.
Diketahui Grafik Titrasi Asam Basa Seperti Berikut

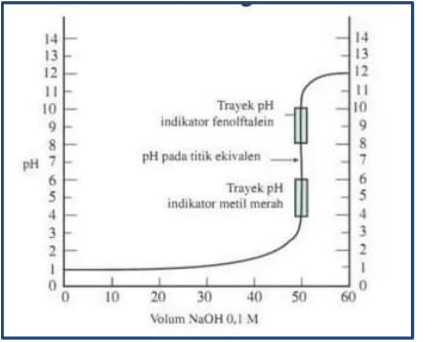
Tidak ada komentar